|
IMPLANTE
DE POLIETILENO POROSO MEDPOR® EM LOJAS CIRÚRGICAS PREPARADAS
EM TÍBIAS DE RATOS. ESTUDO MICROSCÓPICO
POROUS POLYETHYLENE MEDPOR® IMPLANT IN SURGICAL CAVITIES INTIBIAE
OF RATS. A MICROSCOPIC STUDY
Tetuo OKAMOTO *
Ana Mara Moraes de SOUZA **
Osvaldo MAGRO FILHO ***
Idelmo Rangel GARCIA JÚNIOR ***
Foi avaliado, por meio
de cortes histológicos, o resultado do implante de polietileno poroso
MEDPOR® em lojas cirúrgicas preparadas em tíbias de ratos.
Para tanto, foram empregados 24 ratos. Após a anestesia geral com
Pentobarbital sódico, foi realizada a depilação do
campo opératório. A seguir foi realizada a antissepsia, incisão
e descolamento do retalho para exposição da tíbia.
Empregando broca de fissura montada em micromotor, foram realizadas, em
cada animal, 2 cavidades de aproximadamente 3mm de diâmetro. A cavidade
superior recebeu o implante de polietileno poroso com dimensão de
aproximadamente 2x2mm. A cavidade inferior permaneceu como controle. A seguir
o retalho foi recolocado e suturado. Decorridos 10, 30 e 60 dias após
o implante, os animais foram sacrificados e as peças obtidas, submetidas
ao processamento laboratorial de rotina. Após a inclusão em
parafina foram realizados cortes semi-seriados. Os cortes foram corados
em hematoxilina e eosina para estudo histomorfológico.
Os resultados obtidos mostram que o material não sofre reabsorção
quando reimplantado em tíbias e permite a neoformação
conjuntiva e óssea adjacente às suas bordas.
UNITERMOS: Implante aloplástico; Polietileno poroso, Tíbia.
O emprego de implantes e enxertos tem sido realizado de longa data no
tratamento de deformidades crânio-faciais para melhorar as condições
morfo-funcionais. Os defeitos ósseos exagerados ocasionados por
traumas, neoplasias ou infecções não reparam espontaneamente
e, quando isso ocorre, nem sempre reproduzem-se totalmente a forma e a
função da maxila ou mandíbula.
Por outro lado, lacunas decorrentes de amplas ostectomias no esqueleto
facial necessitam de transplantes para estabilizar os segmentos12,
24.
Sob o ponto de vista da aceitação biológica, em função
da superior compatibilidade tecidual, o melhor material de enxerto ou
transplante é o autógeno. Entretanto, quando são
utilizados enxertos autógenos, existe a necessidade de ato cirúrgico
adicional para a remoção do material, criando uma ferida
cirúrgica cujo pós-operatório é, sob o ponto
de vista clínico, mais desconfortável
ao paciente do que a intervenção cirúrgica para a
correção da deformidade12, 15. 18.26.
Já nos enxertos homógenos, além da obtenção
do enxerto, há necessidade de meios para sua conservação.
Assim, bancos de enxertos são criados para viabilizar meios de
conservação que venham facilitar o uso de tecidos em condições
de serem utilizados como implante.
No entanto, essas dificuldades citadas não devem impedir a utilização
de enxertos autógenos ou homógenos, quando a sua aplicação
estiver indicada.
Com o advento de novas técnicas, principalmente de regeneração
guiada, em Periodontia e Implantodontia, em que pequenas quantidades de
material particulado são necessários, voltou a crescer o
interesse pela utilização de materiais aloplásticos
e enxertos homógenos e heterógenos, que permitem a sua utilização
sob anestesia local28.
Dentre os materiais
aloplásticos, o proplast14, O silicone5,33
e o polietileno poroso37 são empregados em
variadas intervenções cirúrgicas.
Particularmente o polietileno poroso vem sendo utilizado em traumatologia
buco-maxilo-facia18,13, 27, 29, 38, em cirurgias
crâneo-faciais37, em oftalmologia2,11,
30, em ortopedial1, 10, 25. em neuro-cirurgia3,
em cirurgia plástica35, 36 e há alguns
estudos experimentais em torno deste tipo de material aloplástico4,6,
7, 31.
O polietileno poroso é considerado biocompatível, tanto
é que há várias metodologias que o empregam como
referencial para avaliar outros materiaisl7.23.34.
JAZAYERI et al, (1994)9 observaram que defeitos
ósseos em crânio de ratos, quando preenchidos com polietileno
poroso, associado à matriz óssea desmineralizada, oferece
ótimo suporte para crescimento ósseo sem infiltrado inflamatório.
Com referência ao leito receptor, a tíbia de rato tem sido
utilizada para a avaliação da resposta tecidual frente a
implantes ou enxertos em trabalhos experimentaisl9,20,
21. Neste local é possível, mesmo em animais de dimensões
reduzidas, como é o rato, obter um leito receptor ósseo
que permite a manutenção do implante em contato com osso
cortical e medular.
Assim, em vista de ausência de estudos similares, é objetivo
deste trabalho avaliar em cavidades cirúrgicas preparadas em tíbias
de ratos o implante de polietileno poroso, por meio de cortes histológicos.
Para o presente trabalho
foram empregados 24 ratos (FZattus noruegicus albinus, Wistar), machos,
com peso variando de 250 a 300 gramas, que foram mantidos durante todo
o período experimental com ração comercial balanceada
(Anderson Clayton S.A.).
1) Procedimentos cirúrgicos para o implante
Para a realização do implante, os ratos foram submetidos
à anestesia geral pela injeção intraperitoneal de
Pentobarbital sódico (Hypnol Cristalia), na dosagem aproximada
de 50mg por quilograma de peso corporal. A seguir foi feita a depilação
do campo operatório e antissepsia com solução de
clorexidina a 92%. A seguir, foi realizada uma incisão linear de
20mm de extensão e
deslocamento do retalho para exposição da tíbia.
Com broca de fissura n°- 701 montada em micromotor foram preparadas
duas cavidades de aproximadamente 3mm de diâmetro e em profundidade,
atingindo a medula óssea. A distância entre as duas cavidades
foi em torno de 1Omm; durante o uso do instrumento rotatório, foi
feita irrigação constante com soro fisiológico com
auxílio de seringa Luer, para evitar aquecimento excessivo.
Após irrigação e limpeza, a cavidade superior recebeu
o implante de polietileno poroso MEDPOR® (Porex Surgical Inc.) com
diâmetro aproximado de 2x2mm. A cavidade inferior permaneceu sem
implante e serviu como controle.
'Após a recolocação do retalho em posição
foi realizada a sutura interrompida com fio de poliglactina 910 - 4 -
0, (Ethicon).
2) Processamento Laboratorial
Em número de seis para cada período, os animais foram sacrificados
aos 10, 20, 30 e 60 dias após o implante. Sacrificado o animal,
as tíbias com lojas cirúrgicas foram removidas e fixadas
em formalina a 10%. A seguir, foram descalcificadas em solução
de ácido fórmico e citrato de sódio em partes iguais'6
e incluídas em parafina para possi- .. bilitar a microtomia. Os
cortes semi-seriados com 6 micrômetros de espessura foram corados
em hematoxilina e eosina para estudo microscópico.
Na avaliação dos resultados, foram considerados principalmente
a neoformação conjuntiva e óssea em presença
do implante de polietileno poroso.
10 Dias
Grupo I (implante). Em todos os espécimes, o implante encontra-se
na íntegra no interior da loja cirúrgica sem evidências
de reabsorção. Em contato com o material, observa-se delgada
faixa de tecido conjuntivo neoformado (Figura 1 ). Logo a seguir, notam-se
trabéculas ósseas neoformadas delgadas que exibem amplo
espaço inter-trabecular e elevado número de osteoblastos
em suas bordas (Figura 1 ). Em alguns casos evidencia-se formação
de tecido em íntimo contato com o implante.
Grupo II [controle). A loja cirúrgica mostrajunto ao fundo
e bordas laterais a presença de tecido ósseo neoformado
(Figura 2). Nas demais áreas, a loja cirúrgica é
ocupada por tecido conjuntivo bem diferenciado com feixes do fibras colágenas,
geralmente orientadas paralelamente à superfície externa.
20 Dias
Grupo I (implante). Em todos os espécimes, o implante acha-se
na íntegra sem indícios de reabsorção. Nas
proximidades do material observam-se trabéculas mais desenvolvidas
que aquelas observadas no estádio anterior (Figura 3). Em alguns
pontos formam-se trabéculas ósseas em contato com o implante
e em outros, nota-se a presença de tecido conjuntivo bem desenvolvido,
principalmente junto à borda externa da loja cirúrgica (Figura
3).
Grupo II (controle). Com exceção de pequenas áreas
junto a superfície externa, a loja cirúrgica encontra-se
ocupada por trabéculas ósseas bem desenvolvidas (Figura
4). O tecido conjuntivo junto à superfície externa, bem
desenvolvido, mostra a presença de fibras colágenas distribuídas
paralelamente à superfície externa.
30 Dias
Grupo I (implante). O material do implante encontra-se na íntegra
ocupando parcialmente a loja cirúrgica. Em alguns pontos, observa-se
tecido ósseo neoformado em contato com o material e, em outros,
a presença de tecido conjuntivo separando o implante e tecido ósseo.
Na área junto à superfície externa da cavidade nota-se
tecido conjuntivo bem desenvolvido em contato com o material, mostrando
feixes de fibras colágenas.
Grupo II (controle). A loja cirúrgica acha-se tdtalmente
preenchida por trabéculas espessas e bem desenvolvidas.
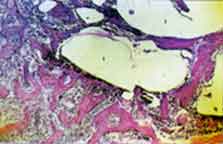 Figura 1
Figura 1 |
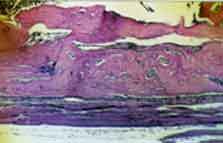 Figura 2
Figura 2 |
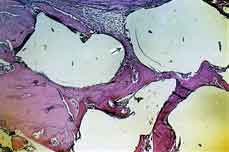 Figura 3
Figura 3 |
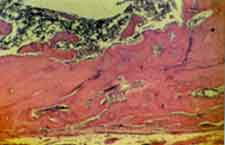 Figura 4
Figura 4 |
60 Dias
Grupo I (implante). O material de implante encontra-se na íntegra
ocupando parcialmente a loja cirúrgica. Aproximadamente dois terços
da superlície do material acham se em contato com tecido ósseo
bem desenvolvido (Figura 5). O tecido conjuntivo sem diferenciação
óssea junto ao implante é bem desenvolvido e rico em fibras
colágenas.
Grupo II (controle). A totalidade da loja cirúrgica encontra-se
preenchida por trabéculas ósseas bem definidas (Figura 6).
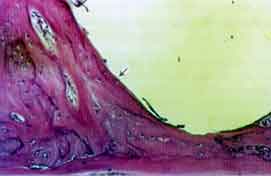 Figura 5
Figura 5 |
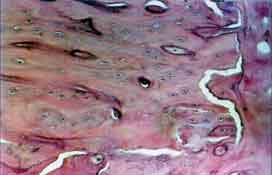 Figura 6
Figura 6 |
Os implantes de materiais
aloplásticos, tanto de natureza sintética quanto de origem
orgânica, são avalizados em trabalhos éxperimentais
com o objetivo de selecionar aqueles com possibilidade de emprego em intervenções
cirúrgicas da cavidade bucal32. Por exemplo, as lacunas ocasionadas
por amplas ostectomias no esqueleto facial necessitam de implantes para
estabilizar os seguimentos12.
O polietileno poroso utilizado no presente trabalho vem sendo empregado
em traumatologia buco-maxilo-facial e é considerado um material
biocompatível17,23. 34.
No presente trabalho, a tíbia de rato foi escolhido como leito
receptor para avaliação da reação tecidual
após implante, por ser uma área de osteogênese ativa,
tendo sido utilizada em outros trabalhos experimentais19,
20. 21, Neste local é possível, mesmo em animais
com dimensões reduzidas, como é o rato, obter um leito receptor
ósseo que possibilita a permanência do implante em contato
com o osso cortical e medular.
Diversos trabalhos experimentais realizados anteriormente indicam que
todo material que apresentar certo grau de irritabilidade aos tecidos
ocasiona retardo no processo de reparação tecidual. Os resultados
obtidos no presente trabalho mos
tram a excelente biocompatibilidade do material, comprovada pela rápida
formação de tecido conjuntivo junto ao implante em lojas
cirúrgicas preparadas em tíbia de ratos. Nos períodos
mais longos, observamos a formação de tecido ósseo
em contato com o material de implante.
OKAMOTO et al. ( 1998)22 realizaram o implante do mesmo material em nível
de alvéolo dental após a exodontia, obtendo resultados que
se assemelham a estés verificados no presente trabalho.
Por outro lado, estes resultados vão ao encontro daqueles relatados
por WILLISZ et al, 199238; WILLISZ, 199335;
ROMANO et al, 199329; GOLDBERG, 19946
e KAREST et al, 199411 que, em avaliações
clínicas em pacientes, empregando 0 polietileno poroso, obtiveram
resultados satisfatórios.
A boa aceitação do material pelo organismo se deve, ao que
tudo indica, à baixa irritabilidade do material aos tecidos, ao
lado de características do leito receptor que é uma área
de osteogênese ativa.
Uma outra particularidade interessante apresentada pelo polietileno poroso
é a ausência de sua reabsorção ao longo dos
períodos pós-operatórios estudados. Da mesma forma,
não foi observada também, em nenhum espécime, a reabsorção
da parede óssea da loja cirúrgica, mesmo nas áreas
em que o material encontrava-se em contato com o tecido ósseo preexistente.
Em outros trabalhos experimentais com metodologia similar a esta, empregando-se,
porém, diferentes tipos de implantes aloplásticos como o
"osso sintético", gesso de Paris e cera óssea,
foram verificadas reabsorções ósseas precedidas de
reação inflamatória.
De acordo com os resultados obtidos no presente trabalho, podemos sintetizar
alguns aspectos que consideramos de interesse como: ausência de
reabsorção do material, neoformação óssea
adjacente ao implante e a não-interferência na evolução
do processo de reparação tecidual.
Muito embora estes resultados indiquem a excelente qualidade do material
de implante, há necessidade de novos estudos para chegar-se a resultados
mais conclusivos sobre a sua possível aplicação em
intervenções cirúrgicas da cavidade bucal.
Dentro das condições
experimentais seguidas no presente trabalho, é possível
concluir:
1 ) O material não sofre processo de reabsorção quando
implantado em cavidades preparadas em tíbias;
2) Permite neofo
rmação conjuntiva e óssea adjacente ao material de
implante.
Ao CNPq pelo auxílio
no desenvolvimento do trabalho (Proc.820.437/91-3).
A histomorphologic study
was done in order to evaluate the tissue reaction of an experimental osseous
cavity performed in tibial into which porous polyethylene Medpor® was
implanted. Twenty four rats underwent general anesthesia using Sodium Pentobarbital.
The skin was prepared using antiseptic solution and the tibiae bone was
exposed after skin incision and divultion. Two 3mm diameter cavities were
dug in each animal. The superior cavity was filled by 2 x 2mm porous polyethylene
implant and the lower cavity was the control group. The deep and superficial
soft tissue layer sutures were done. The animals were sacrificed ten, thirty,
and sixty days postoperatively. Histologic preparations were stained with
hematoxilin and eosin. The results showed that the material is not resorbable
and there is connective and bone tissue neoformation around the porous polyethylene
Medpor® implant.
UNITERMS: Alloplastic implants; Porous polyethylene; Tibiae.
|
REFERÊNCIAS BIBLIOGRÁFICAS |
1. AZUMA, T., et al. Compressed allograft chips for acetabular reconstruction
in revision hip arthroplasty. J. Bone Joint Surg. Br., v. 76, n.5, p.7404,
1994.
2. BARTLEY, R.E., et al. Polyethylene wear in unicompartimental knee arthroplasty.
Clin. Orthop.,v.feb., n.299, p.18-24, 1994.
3. COUDWELL, W.T., ét al. Cranioplasty with the Medpor porous polyethyelene
flexblock implant. Technical note. J. Neurosurg., v.81, n.3, p.483-86,
1994.
4. DOUGHERTY, W.R., WELLISZ, T. The animal hsistory of alloplastic implants
in orbital floor reconstruction: an animal model. J. Craniofac. Surg.,
v.5, n.l, p.2632, 1994.
5. GLASGOLD, A.I., GLASGOLD, M.J. Intraperative custom contouring of the
of the mandible. Arch. Otolaryngol. Head. Neck. Surg., v.120, n. 2, p.180-4,
1994.
6.GOLDBERG, R.A. et al. Animal model of porous polyethylene orbital implants.
Ophthal. Plast. Reconstr. Surg., v.10, n.2, p.104-9, 1994.
7. GOLDMAN, S., et al. T-lymphocytes are not necessary for particulate
polyethylene-induced macrophage recruitment. Histological studies of the
rat tibia. Acta. Orthop. Scand., v.65, n. 2, p.157-60, 1994.
8. HAUG, R.H., et al. A comparison of microscrew and suture fixation for
porous high-density polyethylene orbital floor implants. J. Ora1 Maxillofac.
Surg., v.5l,n. 11, p. 1217-20, 1993.
9. JAZAYERI, M.A., et al. Comparasion of various delivery systems for
demineralized bone matrix in a rat cranial defect model. J. Cranofac.
Surg., v.5, n.3, p.172-8, 1994.
10. JIN, Z.M., et al. A parametric analysis of the contact stress in ultra-high
molecular weight polyethylene acetabular cups. Med-Eng-Phys., v.16, n.5,
p.398405, 1994.
11. KARESH, J.W., DRESNER, S.C. High-density porous polyethylene (Medpor)
as a successful anophthalnic socket implant. Ophthalmology. v.101, n.10,
p. 168895, 1994.
12. KLINGE, B. et al. Osseous response to implanted natural bone numeral
and synthetic hydrixylapatite ceramic in tbe repair of experimental skull
bone defects. J. Oral. Maxillofac. Surg., v. 50, p.241-249, 1992.
13. LACEY, M., ANTONYSHYN, O. Use of high-density polyethylene implants
in temporal contour reconstruction. J. Craniofac. Surg., v.4, n.2, p.74-8,
1993.
14. MEBRIDE, K.L., BELL, W.H. Surgical correction of dentofacial deformities.
Philadelphia, Saunders Company, 1980, p.1211.
15. MEADOWS, C.L. et al. A comparison of polylactic acid granules and
decalcified freeze-dried bone allograft in human periodontal osseous defects.
J. Periodontol., v.64, p.103-9, 1993.
16. MORSE, A. Formic acid sodium citrate decaldification and butyl alchol
dehydratation of teeth and bone for sectionning in paraffin. J. Dent.
Res., v.24, p. 143, 1945.
17. NAKAMURA, T. et al. Imunorigenicity of poly-L-lactide (PLLA) plates
compared with medical-grade polyethlene. J. Biomed. Mater. Res., v.28,
n.l, p.1725, 1994.
18. OKAMOTO, T., et al. Transplante autógeno de cartilagem hialina
de costela, preservada em glicerina, após remoção
de percôndrio, para processo malar de ratos. Estudo histológico
(Parte II). Reu. Odontol. USP.,v.J, p. 112-17, 1991.
19. OKAMOTO, T. et al. Implante de osso anorgânico em cavidade óssea.
Estudo histológico em ratos. Reu. Odont. UNESP, v.23, p.213-19,
1994.
20. OKAMOTO, T. et al. Osseous regeneration in the presence of fibrin
adhesive material (Tissucol®) and epsilon-aminocaproic acid (EACA)
. Bras. Dent. J., v. 6, p. 77-83, 1995.
21. OKAMOTO, T. et al. Implante da associação esponja de
fibrina (Fibrinol®) /adesivo fibrínico (Tissucol®) em cavidade
cirúrgica preparada em tíbia de rato. Estudo histológico.
Reu. Odontol. USP.,v. 10, p. 33-7, 1996.
22. OKAMOTO, T. et al. Implante de polietileno poroso MEDPOR® em alvéolo
dental de incisivo de rato. Estudo histomorfológico. SALUVISTA,
v.17, n.l, p.139-53, 1998.
23. OLSEN, F.K. et al. Osseous reaction to implanted zoe retrograde filling
materials in the tibia óf rats. J. Endod., v.20, n. 8, p.389-94,
1994.
24. PEREIRA, M.B. Osso anorgânico: material para implante
na rotina odontológica. Reu. Assoc. Paul. Cir. Dent., , v.15, p.113-26,
1961.
25. PIDHORZ, L.E. et al. Histological study of the porous . coating of
the uncemented acetabulum. Apropos of ~ 11 implants removed at autopsy.
Chirurgie., v.119, i, n.6-7, p.334-39, 1993-4.
26. PURCHIO, R.A.J. et al Avaliação da estrutura física,
,, composição química e pH de biocerâmicas
de cálcio ' e fosfato e suas implicações na eleição
do material ideal para enxerto ósseo. In: Congresso Brasileiro
j de Engenharia e Ciências dos Materiais, 10, 1992, ~ Águas
de Lindoia. Anais, 1992 p. 5-7.
27. REMULLA, D. et al. Complications of porous spherical ',, orbital implants.
Ophthalmology, v.102, n.4, p.596-'., 93, 1995.
28. RIOS, A.L.B.B. Comportamento biológico de implantes de'~ osso
bouino anorgânico em arco zigomático de ratos. '~ Estudo
histológico. Araraquara, 1995. Dissertação' .
de Mestrado - Faculdade de Odontologia, de, Araraquara, Universidade Estadual
Paulista.
29. ROMANO, J.J. et al. Use of Medpor porous polyethylene,~ implants in
140 patients with facial fractures. J., Craniofac. Surg. v.4, n. 3, p.
142-7, 1993.
30. RUBIN, P.A. et al. Orbital reconstruction using porous. polyethylene
sheets. Ophthalmogy, v.101, n.10, p. 1697-708, 1994a.
31. RUBIN, P.A. et al. Comparasion of fibrovascular ingrowth into hydroxyapatite
and porous polyethylene orbital implants. Iophthal. Plast. Reconstr. Surg.
v.10, n.2, p.96-103, 1994b.
32. SANCHES, M. G. et al. Processo de reparo em feridas de extração
dental após implante de "osso anorgânico". Estudo
histológico em ratos. Reu. Fac. Odont. Araçatuba, v.26,
n.l, p.125-28, 1972.
33. SCLAROFF, A. WILLIAMS, C. Augmentation genioplasty: when bone is not
enough. Am. J. Ota(aryngol., v.13, n.2, p.105-8, 1992.
34. SIDDI~UI, W.H. et al. Reproductive and developmental toxicity studies
of silicone, elastoner ~-7-2423/~72551 in rats and rabbits. Fundam. Appl.
Toxicol., v.23,. n.3, p.377-81, 1994.
35. WELLISZ, T. Clinical experience with the Medpor porous polyethylene
implant. Aesthetic. Plast. Surg., v.17, p.339-44, 1993.
36. WELLISZ, T. DOUGHERTY, W. The robe of alloplastie skeletal modification
in the recosntruction of facia~ burns. Ann, Plast. Surg., v.30, n.36,
p. 531-36, 1993,
37. WELLISZ, T. et al. Cranofacial applications for the Medor porous polyethylene
flexblock implant. J. Craniofac. Surg., v.3, n.2, p.101-7, 1992.
38. WORLEY, C.M. STRAUSS, R.A. Augmentation of the anterior temporal fossa
after temporalis muscle transfer. OralSurg. OraIMed. Pathol.,v.78, n.2,
p.14650, 1994.
* Professor Titular da Disciplina de Cirurgia do Curso de Ciências
Odontológicas da UNIMAR, Marília-SP, Brasil.
** Ex-Bolsista de Aperfeiçoamento do CNPq/UNESP, Araçatuba-SP.
Brasil.
*** Professores do Departamento de Cirurgia e Clínica Integrada
- Faculdade de Odontologia da UNESP, Araçatuba - SP. Brasil. Endereço:
Rua Francisco Braga. 335 - CEP 16015-560 - Araçatuba - SP, Brasil.
Fone : (018) 623-5451
|